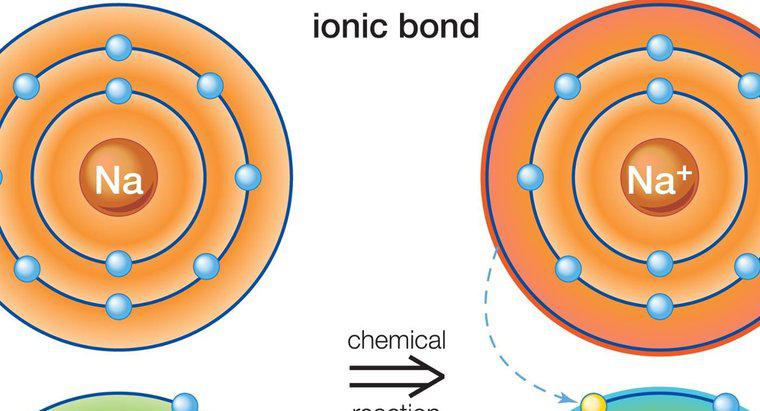
Legarea covalentă descrie procesul în care doi atomi formează o legătură prin împărțirea unuia sau mai multor electroni pentru a umple orbita lor exterioară și pentru a deveni mai stabili. Legarea covalentă are loc în mod obișnuit între două nemetale, care sunt situate în cea mai mare parte pe partea dreaptă a tabelului periodic.
O legătură covalentă poate fi fie polară, fie nepolară, în funcție de electronegativitățile celor doi atomi implicați. Electronegativitatea este o măsură a cât de puternic un atom poate atrage un electron. Dacă atomii care formează o legătură covalentă au electronegativitți diferiți, atomul cel mai puternic va avea o sarcină ușor negativă la locul legăturii, în timp ce celălalt atom va fi puțin pozitiv.