Legarea ionică implică un metal și un metal. Aceasta deoarece legarea ionică implică transferul electronilor de valență. Legătura rezultată creează două ioni încărcați opus.
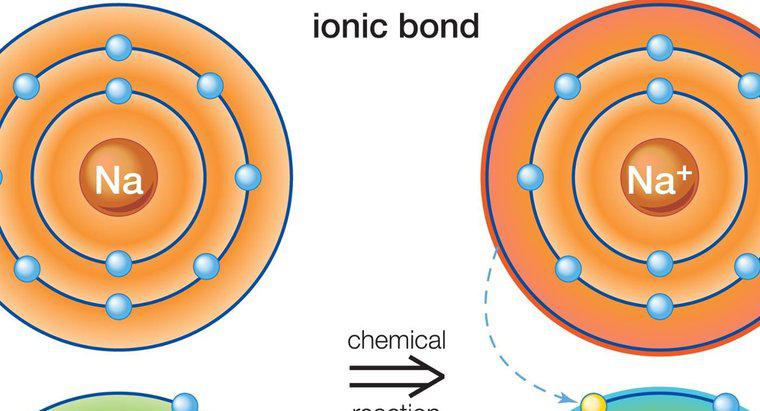
Legarea ionică are loc între metale și nemetale, deoarece metalele au câțiva electroni în inelul exterior. Acest lucru face ca metalele să fie mai pregătite să-și piardă electronii, deoarece acest lucru va duce la obținerea unei configurații stabile a ionului. Unele nemetale au aproape opt electroni și necesită mai mulți electroni pentru a obține o configurație de gaz nobil.Mai mult de un electron poate fi împărțit între elemente. Pe măsură ce un element câștigă și altul pierde, acest lucru duce la un element care devine încărcat pozitiv, iar celălalt încărcat negativ. Indiferent dacă elementul devine pozitiv sau negativ, depinde de pierderea sau câștigarea electronilor. O pierdere va duce la o încărcare pozitivă, în timp ce un electron suplimentar duce la o încărcare negativă. Încărcarea netă în compus trebuie să fie zero. Deoarece este întotdeauna electronii donatori de metal, elementul metalic este pozitiv, iar elementul nemetalic este negativ.
Exemplul unei legături ionice este compusul de clorură de sodiu, cunoscut în mod obișnuit ca sare de masă. Sodiul conține un electron în inelul său exterior, în timp ce clorul conține șapte. Sodul transferă electronul în clor și devine încărcat pozitiv, în timp ce clorul devine încărcat negativ. Încărcarea netă a compusului este zero, deoarece cele două elemente s-au legat.