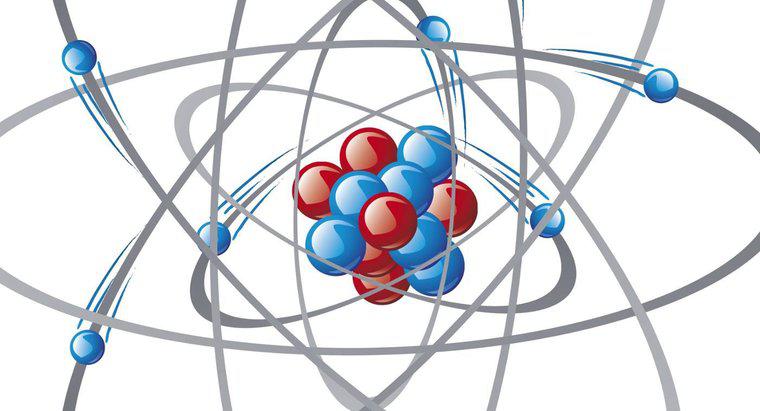
Configurația electronică a unui atom se referă la modul în care electronii sunt aranjați în cochilii orbitali ai atomului și subsolurile sau subshellurile. Configurația orbitală a electronilor unui atom este un factor primar în determinarea proprietățile sale. Cea mai semnificativă orbită a electronului în legătură cu modul în care atomul va reacționa cu alți atomi este cochilia cea mai exterioară sau cochilia de valență.
Electronii vor umple orbitele unui atom într-o anumită ordine. Acest lucru se datorează faptului că fiecare electron are o sarcină electrostatică negativă care respinge ceilalți electroni. Atomul încearcă să se potrivească cu electronii într-un aranjament care minimizează efectul încărcăturilor repulsive. Nu mai mult de doi electroni pot ocupa aceeași orbitală și atunci când doi electroni împart o orbită, trebuie să aibă spinări opuse.
Configurările de electroni pot fi descrise prin specificarea numărului de electroni care se găsesc în fiecare coajă de electroni a atomului și în orbitalii din subsolurile acelei cochilii. Suprajele într-o coajă de electroni sunt notate ca s, p, d și f. Aceste subsoluri orbitale și configurațiile electronilor lor sunt reflectate în tabelul periodic al elementelor, care conține un bloc s, un bloc p, un bloc d și un bloc f. Configurația electronilor unui atom poate fi observată în trei moduri: într-o diagramă orbitală, notație spdf sau notație de gaz nobil.