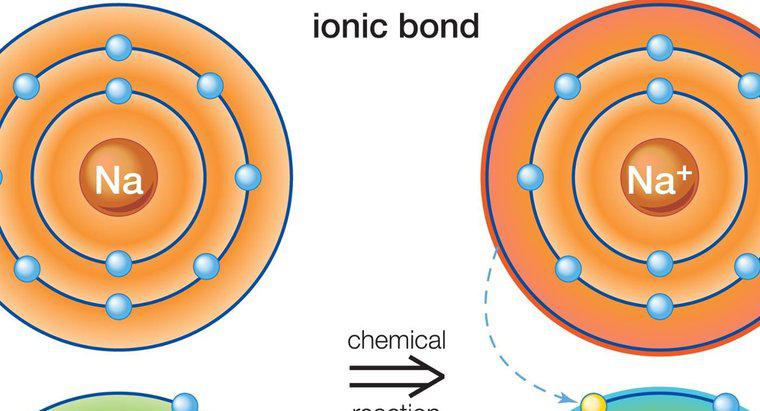
Compușii ionici sunt solizi, au puncte de topire ridicate, conduc electricitate, sunt tari dar fragili și sunt formați dintr-o legătură ionică între un metal și un metal. O legătură ionică este o legătură între două elemente cu taxe opuse. Acuzațiile opuse se atrag, creând o legătură chimică puternică.
Compușii ionici se dizolvă ușor în solvenți polari, cum ar fi apa. Ele nu se dizolvă ușor în solvenți nepolari, care includ eter și benzină. Acest lucru se datorează faptului că compușii ionici tind să formeze molecule polar, care se dizolvă în soluții de polaritate similară. Un solvent nepolar nu furnizează suficientă energie pentru ruperea legăturii ionice și pentru dizolvarea structurii cristaline a compusului.Proprietățile conductive ale compușilor ionici se aplică atunci când sunt dizolvați într-o soluție ionică sau atunci când sunt topiți. Atunci când compușii ionici sunt solizi, sunt mai degrabă izolați electrici decât conductori. Acest lucru se datorează faptului că încărcăturile electrice nu pot trece prin structura de zăbrele strânsă a unui compus ionic în stare solidă.
Clorura de sodiu, cunoscută și sub denumirea de sare de masă; clorură de potasiu, care este utilizată în medicină și ca înlocuitor de sare; și corundul, mineralul din care sunt compuse rubinele și safirul, sunt compușii ionici bine-cunoscuți. Toți acești compuși formează structuri cristaline, o altă trăsătură comună a compușilor ionici.