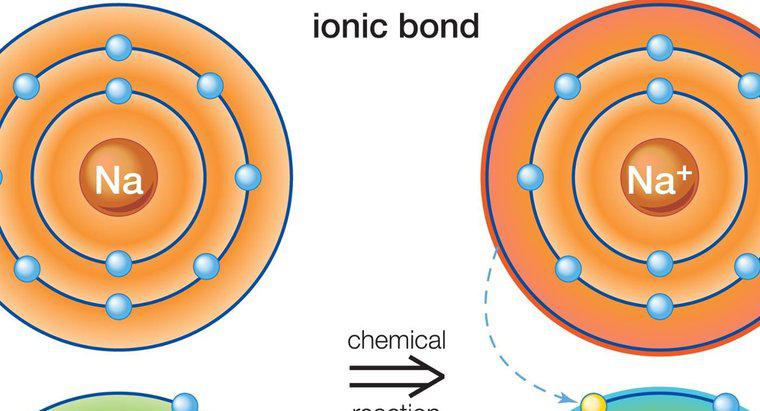
Compușii ionici
Compușii ionici formează ca rezultat al atomilor sau moleculelor care atrag mai mulți atomi sau molecule cu o încărcătură opusă. Compoziția variază în funcție de tipul compusului, dar toți compușii ionici trebuie să aibă o sarcină electrică neutră. Asta înseamnă că ele trebuie să aibă un raport egal între moleculele anionice și cationice.
Compuși moleculari
Compușii moleculari, numiți și compuși covalenți, împart electroni prin formarea legăturilor covalente. În timp ce compușii ionici pot consta din atomi și molecule metalice și nemetalice, legăturile covalente se pot forma numai din atomi și molecule nemetalice. Se formează un compus covalent atunci când atomii din diferite elemente sunt combinați prin molecule. Această legătură permite schimbul de electroni de valență, ceea ce creează o atracție comună care ține împreună atomii din moleculă.
Compușii covalenți variază considerabil în dimensiune. Unele sunt mici, cu doar câteva elemente, în timp ce altele pot avea mii de atomi. Deoarece împărtășesc electroni în loc să le schimbe, compușii covalenți au proprietăți considerabil diferite față de compușii ionici. Compușii covalenți tind să ardă cu ușurință, în timp ce compușii ionici nu fac acest lucru. Spre deosebire de compușii ionici, aceștia nu sunt solubili în apă. O altă distincție între cele două tipuri de molecule este aceea că compușii covalenți nu pot conduce electricitate, dar compușii ionici pot în general. La temperatura camerei, compușii cei mai covalenți sunt sub formă lichidă sau gazoasă în loc să apară ca solide. Acest lucru se datorează faptului că moleculele lor individuale sunt mai ușor de separat decât moleculele dintr-un cristal, ceea ce le conferă un punct de fierbere relativ scăzut. Compușii moleculari simpli au aceeași structură de nume. Ele se găsesc pe tabelul periodic prin denumirea elementului care apare cel mai îndepărtat la stânga pe masă, apoi adăugând "ide" la al doilea element numit și folosind prefixele pentru a identifica numărul de atomi din fiecare element. Proteinele și carbohidrații sunt două exemple de compuși moleculari. Alți compuși moleculari includ gaz metan, oxid de azot și clorură de sodiu.