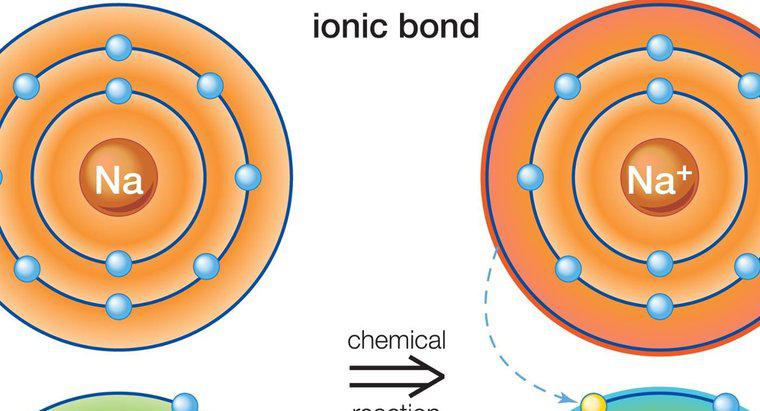
Datorită faptului că acestea sunt rezultatul atracției dintre încărcăturile parțiale și nu încărcările complete, legăturile de hidrogen sunt mult mai slabe decât legăturile ionice sau covalente. Legăturile ionice și covalente atrag atomii diferitelor substanțe pentru a forma moleculele de compuși, în timp ce legăturile de hidrogen sunt forțe care tind să atragă molecule unul față de celălalt. Un exemplu de legare la hidrogen este atracția dintre moleculele de apă individuale, în timp ce atracția dintre atomii de hidrogen și oxigen din fiecare moleculă de apă reprezintă legătura covalentă.
O legătură de hidrogen se formează atunci când un atom de hidrogen pozitiv polarizat într-o singură moleculă este atras de un atom puternic electronegativ într-o altă moleculă. În exemplul moleculelor de apă, atomul oxigen încărcat negativ într-o moleculă de apă atrage atomul de hidrogen încărcat pozitiv într-o altă moleculă de apă. Atomii de oxigen tind să fure electronii departe de atomii de hidrogen din molecule. Când acest lucru are loc într-o moleculă de apă, pierderea de electroni creează un atom de hidrogen cu o sarcină parțială pozitivă, care este apoi atras de un atom de oxigen încărcat negativ într-o altă moleculă de apă.
Legăturile de hidrogen care se formează între moleculele de apă le fac să rămână împreună. Acest lucru dă apă o temperatură cu punct de fierbere ridicat, deoarece este necesar un grad mai mare de energie termică pentru ruperea legăturilor de hidrogen intermolecular. Multe substanțe organice care sunt necesare pentru a susține viața, cum ar fi acizii nucleici și proteinele, conțin legături de hidrogen. Deși aceste legături sunt mai slabe decât legăturile ionice interne sau covalente existente între atomii din cadrul moleculelor, rezistența acumulată a legăturilor de hidrogen din organismele vii este foarte semnificativă și joacă un rol important în menținerea stabilității.