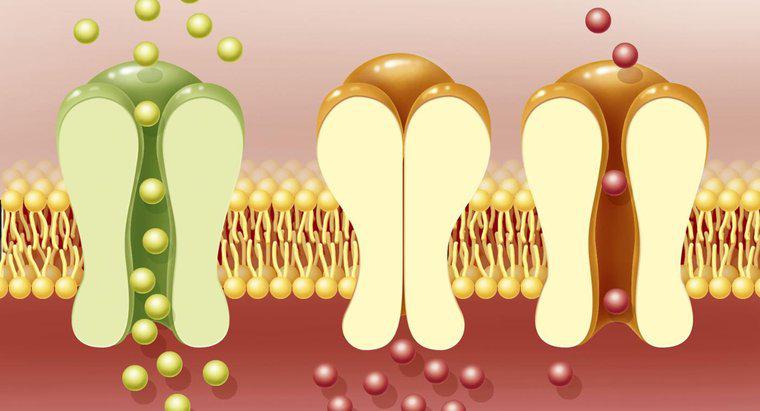
Cele două tipuri de celule electrochimice sunt celule galvanice și celule electrolitice, conform UC Davis. Celulele galvanice suferă reacții chimice spontane și eliberează energie electrică, în timp ce celulele electrolitice consumă energie electrică non-spontană reacții chimice. Ambele tipuri necesită un anod, un catod, soluții de electroliți și o punte de sare.
Celulele galvanice includ dispozitive cum ar fi bateriile nereîncărcabile. Astfel de dispozitive creează un flux de electroni de la un electrod la altul, în general realizat din două metale diferite. Într-o celulă galvanică, electronii curg de la anod la catod. În timpul acestui proces, anodul eliberează ionii metalici într-o soluție de lichid sau gel înconjurător, electrolitul. Când electronii curg spre catod, ei sunt preluați de ionii metalici în soluția care le înconjoară, iar ionii își pierd încărcătura și devin atomi de metal standard.
Bateriile reîncărcabile acționează ca celule electrolitice în timp ce sunt încărcate și celule galvanice atunci când acestea sunt dispozitive de alimentare, în conformitate cu UC Davis. O celulă electrolitică folosește energie electrică pentru a forța o reacție chimică care să apară în direcția opusă, în mod spontan. Astfel, reacția chimică care apare într-o baterie de reîncărcare este exact opusul reacției care apare atunci când bateria eliberează energie.