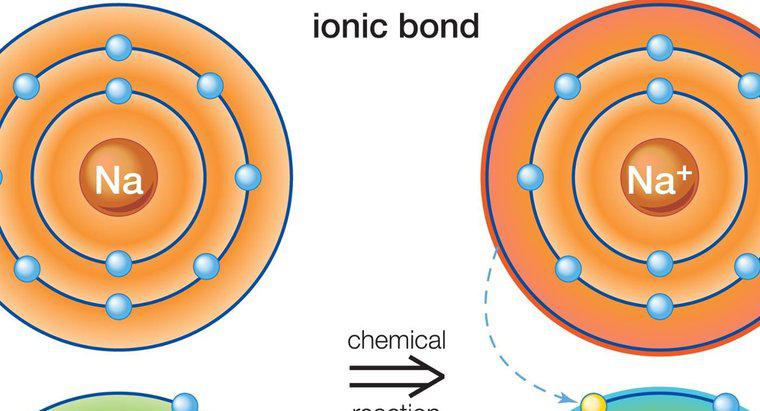
Atomii implicați în legarea ionică sunt ținuți împreună printr-o forță electrostatică de atracție între un ion pozitiv și unul negativ. Legăturile ionice se formează numai între metale și nemetale.
Legarea ionică are loc în prezența unui ion pozitiv și negativ. Ioni se formează atunci când atomii neutrii pierde sau câștigă un electron. Toți atomii pierd sau obțin electroni pentru a obține o configurație stabilă de electroni. Cele mai stabile gaze nobile, toate au opt electroni în cochilii lor exteriori, cu excepția heliului, care are doar doi electroni. Când un atom are opt electroni în cochilia exterioară, se spune că are o structură octet stabilă.Metalele au unul până la trei electroni în cochilia lor exterioară, ceea ce îi împiedică să formeze o structură octetă stabilă. Este mai ușor ca atomii să-și piardă electronii pentru a dezvălui o cochilie subiacentă cu opt electroni, decât să câștige electroni pentru a finaliza structura octetului. Prin urmare, metalele formează ioni pozitivi. Non-metalele, cu toate acestea, tind să câștige unul sau mai mulți electroni pentru a completa octetul în cochilia lor exterioară și, prin urmare, tind să formeze ioni negativi.
Metalele își pot dona electronii nemetalilor. Deoarece încărcăturile pe ioni nu sunt asemănătoare cu (ioni încărcați opuși), atomul de metal încărcat pozitiv este menținut la atomul negativ încărcat nemetal cu o forță electrostatică puternică de atracție.