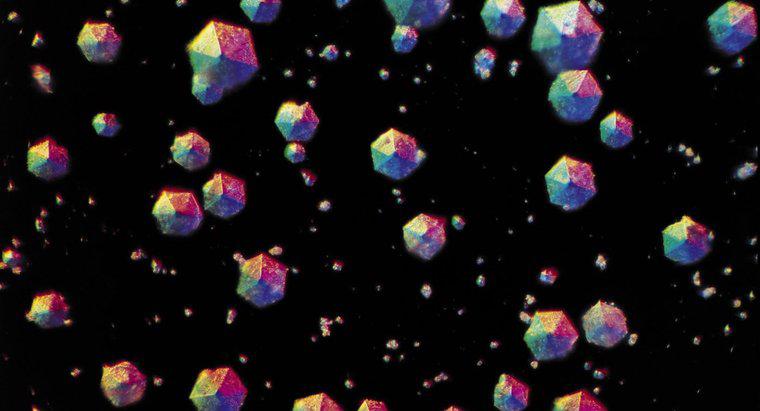Cristalizarea poate fi indusă în mod natural sau artificial. În plus față de cristalele care precipită dintr-o soluție lichidă, cristalizarea poate avea loc, de asemenea, într-un lichid topit care este răcit sau un gaz care este depus pe o suprafață. Cristalizarea are loc în două etape majore: nuclearea și creșterea cristalului.
În timpul fazei de nucleare, moleculele de solvenți dispersate în soluție sunt atrase unul de celălalt, formând clustere de dimensiuni nanometrice. Oprirea procesului în această etapă și stabilizarea nanoclusterilor este o tehnică frecvent utilizată în sinteza nanoparticulelor. Lăsând procesul să continue să producă nuclee stabile care persistă fără a se dizolva înapoi în soluție. Dimensiunea critică pe care aceste nuclee trebuie să o atingă pentru a deveni stabilă depinde de condițiile sistemului cum ar fi temperatura soluției și concentrația solventului. Etapa de creștere a cristalelor implică atragerea ulterioară a unor molecule suplimentare de solvenți la nucleele care au reușit anterior să obțină o dimensiune critică. Acest proces continuă atâta timp cât soluția este suprasaturată: având mai mult solvent dizolvat decât poate suporta în aceste condiții speciale.Ce se separă prin cristalizare?
Crystallizarea separă un solid dizolvat într-un lichid care a format o soluție. Pentru a cristaliza solidul, soluția este încălzită într-un recipient deschis pentru a permite evaporarea lichidului, lăsând solidul cristalin în spatele acestuia.