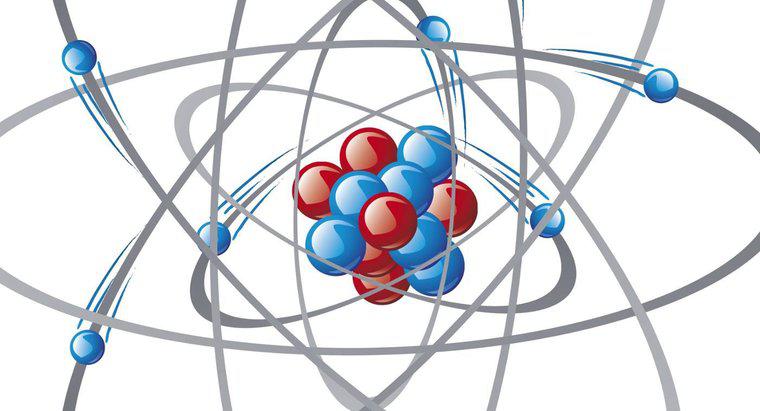
O legătura metalică se formează atunci când electronii de valență nu sunt asociați cu un anumit atom sau ion. În schimb, ele există ca un "nor" de electroni în jurul centrilor ionici.
Materialele metalice au un nivel ridicat de conductivitate electrică și termică în comparație cu materialele cu legături covalente sau ionice. Un metal precum fierul are legături metalice.
În lumea reală și imperfectă, majoritatea materialelor nu au legături pure metalice, covalente sau ionice și pot avea alte tipuri de legături. De exemplu, fierul are o legătură predominant metalică, dar există și o legătură covalentă.
Metalele au de obicei o cochilie plină, plus unul sau doi electroni în plus. Electronii suplimentari din metale nu se limitează la un atom, ci se pot mișca întreaga structură în ceea ce se numește "mare de electroni". Atomii metalici sunt încărcări pozitive în Marea electronică. Ele sunt ținute împreună de electroni. Electronii sunt liberi să se miște. Prin urmare, metalele sunt conductori buni ai căldurii și electricității.
Legătura metalică nu este ca o legătură ionică. Într-un metal, toți atomii sunt aceiași. Nu există cationi și anioni și nu este ca o legătură covalentă. Legătura metalică nu este localizată între doi atomi, iar electronii sunt împărțiți de toți atomii.