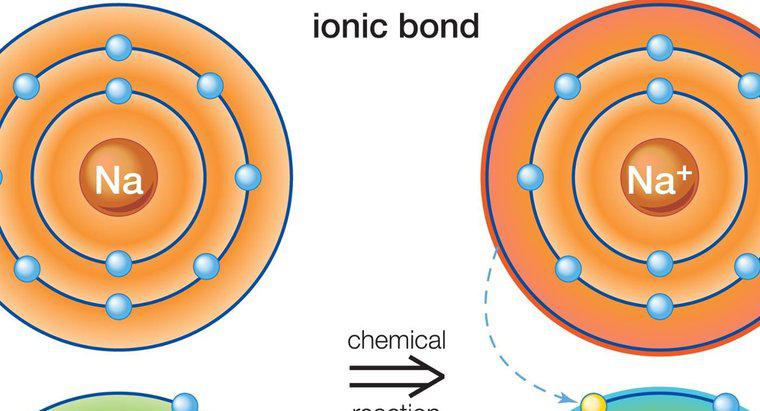
O legătură ionică este un tip de legătură chimică stabilită între doi atomi prin transferul electronilor de valență de la un atom la altul. Acest tip de legătură este, de asemenea, cunoscut ca legătura electromagnetică sau polară. Sărurile sunt un bun exemplu de substanțe realizate cu legătură ionică.
O legătură ionică implică un metal și un atom nemetal. Fiecare atom are tendința de a realiza configurația stabilă a electronilor, ceea ce înseamnă obținerea numărului de octeți (2 sau 8) în cochilia sa. Atomul metalic are exces de electroni deasupra numărului de octeți în cochilie. Pe de altă parte, atomul nemetal este lipsit de electroni și, prin urmare, are nevoie de electroni pentru a-și îndeplini octetul. Odată ce ajung unul la celălalt, atomul de metal își preda surplusul de electroni atomului nemetal. Ca rezultat al acestui transfer de electroni, fiecare dintre atomi atinge configurația de electroni stabil. Compusul se formează prin această legătură numită compus ionic sau electromagnetic. În legăturile ionice, sarcina netă a compusului trebuie să fie zero. Câteva exemple de compuși ionici sunt: NaCl (clorură de sodiu), MgO (oxid de magneziu), CaF2 (fluorură de calciu) și Al2O2 (oxid de aluminiu). În lumea reală, nu se știe că există compuși cu legătură pură ionică. Toți compușii ionici au un grad de legare covalentă