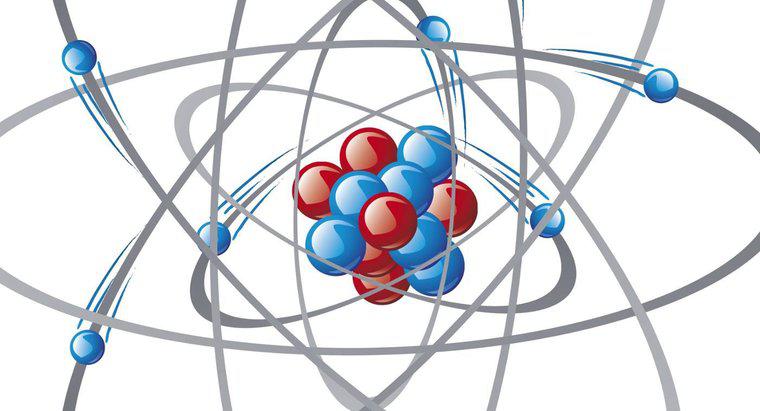
Norul de electroni este o modalitate de vizualizare a rezultatelor ecuațiilor matematice utilizate pentru a calcula poziția unui electron pe măsură ce acesta orbitează nucleul atomului. Zona în care este dens cel mai dens descrie cel mai mult localizarea probabilă a electronului la un moment dat.
Oamenii de știință folosesc multe modele diferite de atomi pentru a înțelege comportamentul lor și interacțiunea cu alte materiale. Modelul lui Bohr din 1913 descrie atomul drept cercuri concentrice de orbitale electronice încărcate negativ care înconjoară nucleul încărcat pozitiv, dar nu este în măsură să explice rezultatele experimentale ale lui Erwin Schrödinger în anul 1926, prin împușcarea particulelor încărcate printr-o fâșie în folie de aur. Modelul cu nori de electroni, cu electroni capabili să se deplaseze prin orbitale cu energii și forme caracteristice, oferă o mai bună potrivire pentru datele experimentale. Ecuația lui Schrödinger, cu infinit de multe soluții, prezice atât forma, cât și densitatea norului. Modelul ia în considerare, de asemenea, principiul incertitudinii lui Heisenberg. Modelul norului de electroni, precum și modelul lui Bohr, consideră că atomii constau numai în particule încărcate pozitiv și negativ. Descoperirea neutronului din 1932 a condus la o rafinare ulterioară a modelului. Din 1932, oamenii de știință continuă să descopere particule suplimentare în atom, ceea ce duce la schimbări în descrierile atomice.