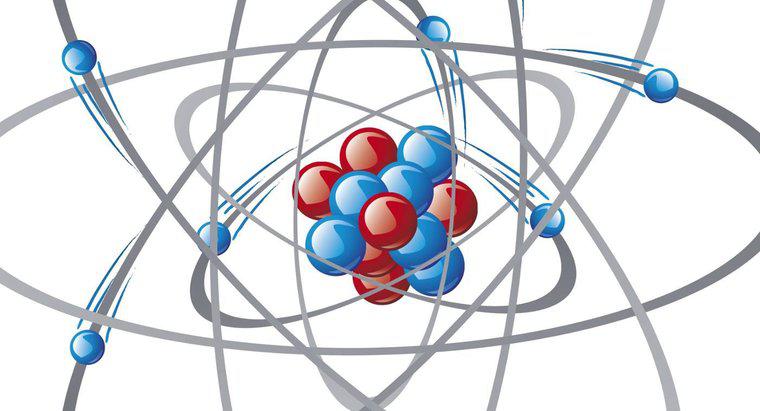
Într-o legătură ionică, un electron lasă un atom să se alăture altui, în timp ce o legătură covalentă este o partajare a electronilor între doi atomi. Legăturile covalente polar apar atunci când doi atomi împart un număr inegal de electroni .
Legăturile chimice se formează datorită interacțiunilor dintre electronii de valență în atomi. Electronii de la Valence ocupă învelișul exterior sau nivelul de energie al unui atom. Dacă cochilia de valență este umplută cu numărul maxim de electroni posibili, aceasta este o cochilie închisă. Atomii cu carapace închise au tendința de a fi inerte și puțin probabil să reacționeze cu alți atomi și molecule. Atomii cu cochilii valente deschise sunt susceptibile de a primi, dona sau împărți electroni pentru a forma o cochilie închisă.
Legăturile ionice implică transferul complet de electroni de la un atom la altul și necesită un donator și un receptor. Atomii cu câțiva electroni din cochilia exterioară sunt cel mai probabil de a dona, în timp ce atomii cu mulți electroni de valență primesc adesea mai mult pentru a forma o cochilie închisă. Legarea ionică duce la formarea a doi atomi încărcați sau ioni. Un exemplu este sarea sau clorura de sodiu. Atomii de sodiu dau ușor electroni, ceea ce are ca rezultat o încărcare pozitivă. Atomii de clor accepta acesti electroni, devenind incarcati negativ. Cei doi atomi încărcați opuși se atașează atunci când se formează o moleculă de clorură de sodiu.Unii atomi împart electroni pentru a obține o cochilie închisă; aceasta se numește legare covalentă. Atomii de oxigen, de exemplu, necesită doi electroni suplimentari pentru a forma o cochilie închisă, în timp ce atomii de hidrogen necesită unul. Un atom de oxigen împarte cu ușurință doi dintre electronii săi cu atomi de hidrogen, astfel încât toți cei trei atomi au închis cochilii. Aranjamentul creează o moleculă de apă. Cu toate acestea, oxigenul exercită o atracție mai mare asupra electronilor decât hidrogenul; astfel, electronii împărțiți petrec mai mult timp în jurul atomului de oxigen decât în jurul atomilor de hidrogen. Atomul de oxigen poartă apoi o sarcină parțială negativă, iar atomii de hidrogen poartă fiecare o sarcină parțială pozitivă. Legătura care are ca rezultat această încărcare inegală se numește o legătură covalentă polară.