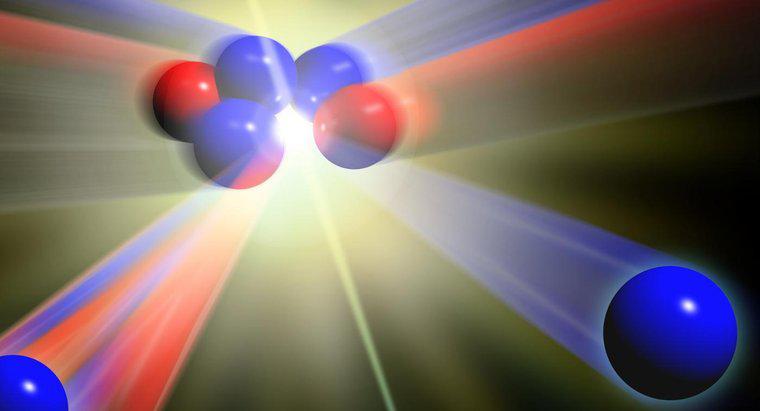
Diferența dintre atomi, ioni și izotopi este numărul de particule subatomice. Un atom este blocul de bază al materiei, cea mai mică moleculă a unui element care există și care nu poate fi divizată chimic mijloace obișnuite. Fiecare atom este compus din protoni, neutroni și electroni. În ioni, numărul de electroni diferă, iar în izotopi, numărul de neutroni variază.
Conform Visionlearning.com, un atom tipic nu are sarcină electrică, deoarece numărul de protoni încărcați pozitiv este același cu numărul de electroni încărcați negativ. Numărul de electroni dintr-un atom se poate schimba, totuși, fie prin câștigarea de electroni suplimentari de la alți atomi, fie prin distrugerea unuia sau mai multor electroni ai atomilor din apropiere. Atunci când un număr de atomi se schimbă, atomul poartă o sarcină electrică. Acest atom încărcat electric este denumit ion.
De obicei, un atom are același număr de protoni și neutroni. Unii atomi câștigă sau pierd un neutron. Când numărul neutronilor dintr-un atom se schimbă, se formează un izotop. Izotopii unui atom au diferite mase atomice și prezintă proprietăți diferite, dar ele sunt încă același element.
Atomii unui element au întotdeauna același număr de protoni.