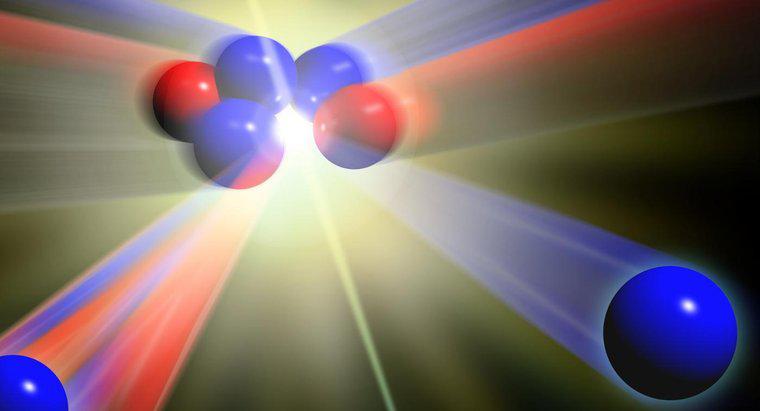
Atomii aceluiași element care au diferite mase se numesc izotopi. Se produc diferite mase atunci când există un număr diferit de neutroni. Toți atomii unui anumit element au același număr de protoni.
Pentru a identifica diferiții izotopi ai unui element, este scris simbolul elementului urmat de numărul de neutroni. De exemplu, două izotopi uzuali de uraniu sunt scrise ca U-236 și U-238.
Un atom are de obicei acelasi numar de neutroni si electroni ca numarul de protoni. Când un atom are un număr diferit de electroni, încărcarea electrică a atomului devine fie pozitivă, fie în cazul în care există mai puțini electroni sau negativi, dacă sunt prezenți electroni suplimentari. Atomii cu încărcătură pozitivă sau negativă sunt numiți ioni. Când un atom are un număr diferit de neutroni, deoarece neutronii nu au încărcătură electrică, încărcarea electrică a atomului nu este afectată. Cu toate acestea, izotopii au o greutate atomică diferită.În tabelul periodic, greutatea atomică sau masa atomică sunt date pentru fiecare element. Numărul nu este un număr întreg, deoarece reflectă abundența naturală a izotopilor unui element. De exemplu, masa atomică a hidrogenului este de 4.003. În calculele de chimie, masa atomică este utilizată cu ipoteza că o probă a elementului include gama naturală de izotopi pentru element.