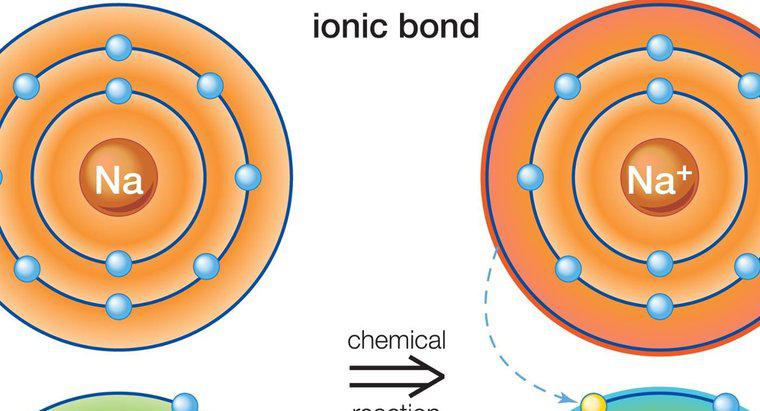
Legăturile covalente polar se formează când legătura dintre doi atomi are o diferență în electronegativitate care este suficient de semnificativă pentru a crea o schimbare în sarcină, dar este mai mică decât diferența necesară pentru a forma o legătură ionică. Într-o legătură covalentă polară, atomii împart electronii neuniform. Aceasta creează o schimbare în dipol și dă un capăt o sarcină ușor pozitivă, iar cealaltă o încărcare ușor negativă.
Când hidrogenul este implicat într-o legătură polară, acesta devine ușor încărcat pozitiv și atrage dipoli încărcați negativ din alte molecule. Cealaltă moleculă nu trebuie să fie globală polară, dar trebuie să aibă legături polare pentru a forma dipolii care atrag sau resping încărcările de hidrogen. Legarea de hidrogen este o formă mai slabă de legare decât legăturile ionice sau covalente, dar este suficient de semnificativă pentru a crea proprietăți unice și forțe atractive, cum ar fi cele observate între moleculele de apă.De ce lipirea hidrogenului este posibilă numai cu hidrogen?
Legarea hidrogen implică deplasările dipol create de legăturile polare și are loc între moleculele care conțin legături polare. Hidrogenul este implicat în mod specific, deoarece elementul are un electronegativ scăzut pentru un metal și creează o schimbare mare a dipolului, care este suficient de puternică pentru a atrage alți atomi electronegativi din legăturile polar în alte molecule.