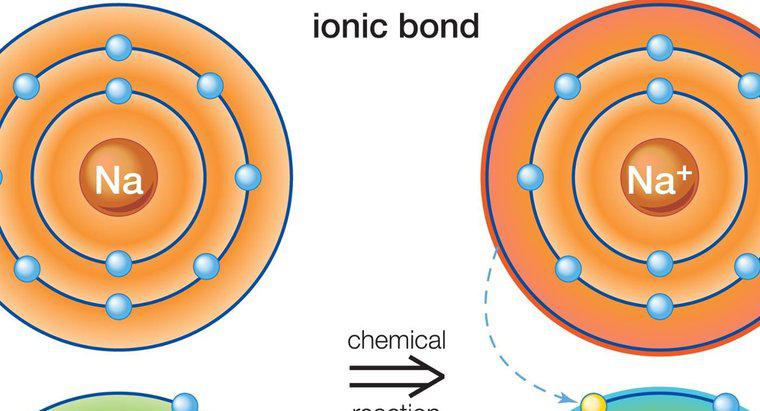
Tipul de legare găsit în clorura de sodiu se numește bonding ionic. Legarea ionică este atracția dintre doi atomi cu încărcături opuse. În clorură de sodiu, sodiul are o încărcătură pozitivă, iar clorul are o încărcătură negativă; prin urmare, ele se atrag și se formează o legătură.
Sodiul și clorul, ca atomi neutri, nu sunt stabili. Sodiul conține un electron de valență, iar clorul are șapte. Regula de octet afirmă că atomii doresc să aibă o cochilie a energiei exterioare ca cea a gazelor nobile, ceea ce înseamnă că au nevoie de opt electroni de valență. Acești opt electroni la nivelul energiei extreme reprezintă stabilitate. Nici sodiul, nici clorul nu au această structură de gaz nobil, astfel încât tind să-și piardă sau să obțină electroni pentru a obține o stare mai stabilă. Sodiul își pierde singurul electron de valență în clor și devine un cation, un atom încărcat pozitiv. Clorul câștigă un electron și devine un anion, un atom încărcat negativ. Acești doi ioni cu încărcătură opusă s-au adunat pentru a forma o legătură ionică.