Atunci când se combină sodiul și clorul, clorul câștigă un electron și sodiul pierde un electron. Ca rezultat, clorul are o încărcătură negativă, iar sodiul câștigă o încărcătură pozitivă. Acest proces este cunoscut sub numele de bonding ionic.
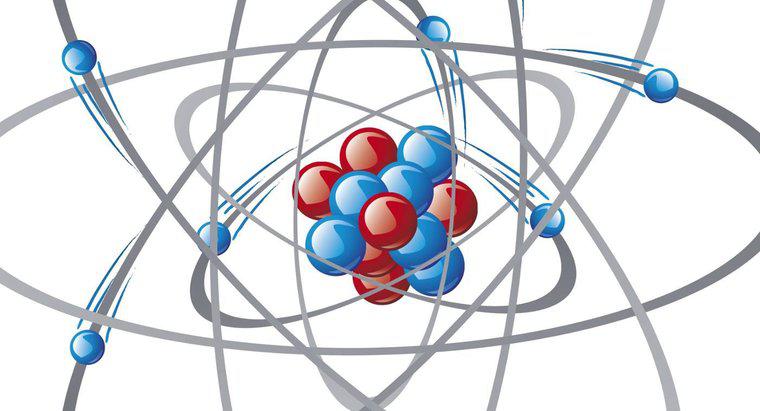
Electronii unui atom nu se găsesc în nucleul cu protoni și neutroni. În schimb, se deplasează în jurul nucleului în orbitale. Aceste orbite sunt denumite și "scoici de energie". Un element este cel mai stabil atunci când are opt electroni în coaja de energie exterioară.
Regula de octet este un principiu de chimie care spune că elementele pierd sau dobândesc electroni în încercarea de a deveni mai stabili. Oamenii de știință spun că încearcă să obțină o configurație de gaz nobil sau devin mai aproape de cel mai apropiat gaz nobil de pe masa periodică. Atunci când clorul reacționează cu alte elemente, de exemplu, încearcă să atingă configurația electronică a argonului.
Deoarece clorul are nevoie doar de un electron pentru a obține o configurație de gaz nobil, este un element foarte reactiv. Este posibil ca un atom de clor să câștige doi electroni, dar ar necesita o energie suplimentară pentru a ridica cel de-al doilea electron. Dr. Anne Marie Helmenstine spune ca clorul are mai multe sanse sa participe la reactii in cazul in care castiga un electron.