Încărcarea globală sau netă a oricărui compus ionic trebuie să fie egală cu zero. Deși ionii înșiși sunt fie pozitivi (cationi), fie negativi (anioni) prin definiție, singura modalitate prin care se pot lega împreună și formează compus este căutând o taxă opusă.
Un compus ionic în chimie se referă la orice compus chimic în care ionii sunt ținuți împreună sau legați prin legături ionice. Legăturile ionice, prin definiție, sunt atracții electrostatice între două ioni cu o încărcătură opusă. Cu alte cuvinte, o legătură ionică se poate forma între un cation și un anion.Deși nu există o limită a numărului de ioni conținute într-un compus ionic, pentru ca compusul să rămână întreg, sarcina netă trebuie să fie egală cu zero. Prin urmare, trebuie să existe un număr egal de cationi și anioni în compusul finalizat.
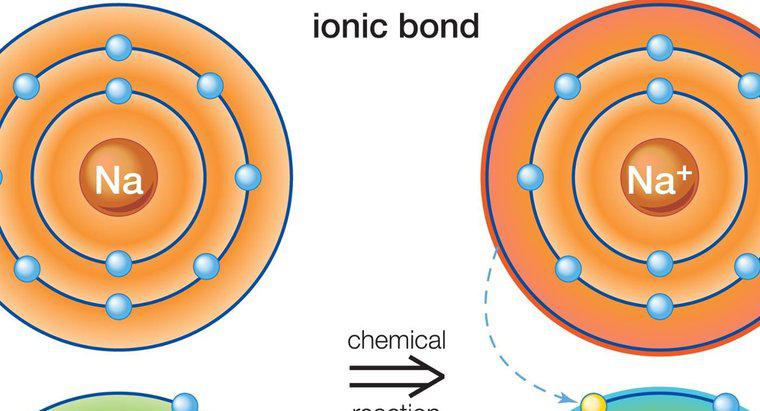
Un exemplu popular și comun al unui compus ionic care afișează acest principiu este sarea de masă sau clorura de sodiu, care are formula chimică NaCl. Formarea sarei de masă este rezultatul unei legături ionice între un cation de sodiu, Na + și un anion de clor, Cl-. Structura fiecărui ion este diferită de un atom al aceluiași element (Na sau Cl) care deține o sarcină neutră datorită unui număr egal de protoni și electroni. Este doar o dată ce fiecare atom devine un ion care este capabil să se lege cu celălalt atom și să creeze un compus ionic.