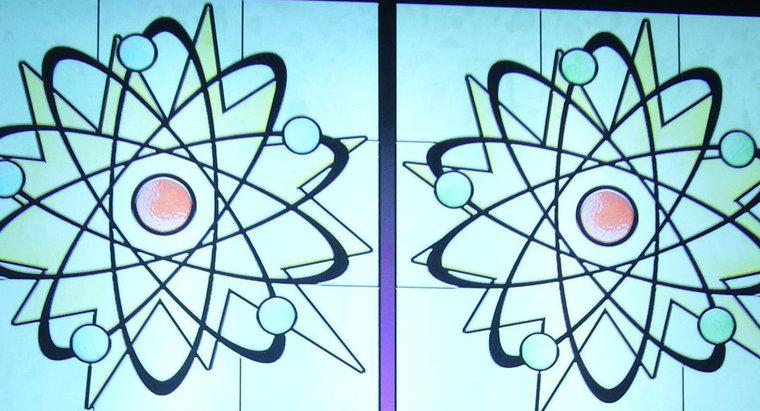
Numărul atomic al unui atom este numărul de protoni care se află în nucleu, în timp ce numărul de masă reprezintă numărul de protoni și neutroni combinați. Numărul atomic determină tipul de element atomic , în timp ce numărul de neutroni determină izotopul elementului. Multe elemente apar în mod natural sub forma a câtorva izotopi diferiți.
Toți atomii au un nucleu, compus dintr-un grup de protoni și neutroni, precum și un "nor" de electroni care înconjoară nucleul. Protonii sunt particule încărcate pozitiv, neutronii sunt particule care nu au încărcătură, iar electronii sunt particule care au o încărcare negativă.
În cele mai multe cazuri, sarcina netă a unui atom este neutră deoarece protonii și neutronii se găsesc în cantități identice. Când un atom câștigă sau pierde un electron, atomul devine un ion încărcat. Dacă un electron este pierdut, atomul devine apoi încărcat pozitiv; totuși, dacă câștigă un electron, atomul devine încărcat negativ.
Dacă un atom pierde un neutron și devine un izotop, proprietățile sale pot fi diferite de cele care se află în configurația naturală. Adesea, atomii care sunt radioactivi suferă un proces de dezintegrare care are ca rezultat pierderea neutronilor de atom.