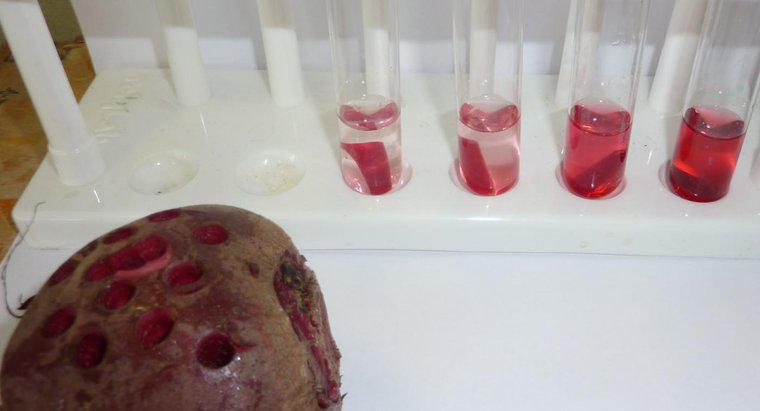
Când apa dizolvă o altă substanță, se datorează faptului că moleculele de apă polară și substanța solută se atrag. Fiecare atom, ion sau moleculă de substanță dizolvată are o încărcătură în cel puțin o regiune care atrage o parte sau alta a moleculei de apă. Ca atare, cât mai multe molecule de apă posibile tind să se adune în jurul fiecărei particule de solvent. În apa lichidă, toate moleculele se află în mișcare constantă, aleatorie, una în jurul celeilalte. Cu toate acestea, datorită atracției, moleculele de apă sunt puțin mai susceptibile de a se deplasa spre particule de substanță dizolvată decât sunt departe de ele și particulele dizolvate sunt mai susceptibile de a se deplasa spre moleculele de apă decât alte particule de solvent. Această mișcare netă rezultă, treptat, într-o distribuție uniformă a substanței dizolvate. În osmoză, numai moleculele de apă se pot mișca pentru a egaliza concentrațiile.
Care este diferența dintre difuzie și osmoză?
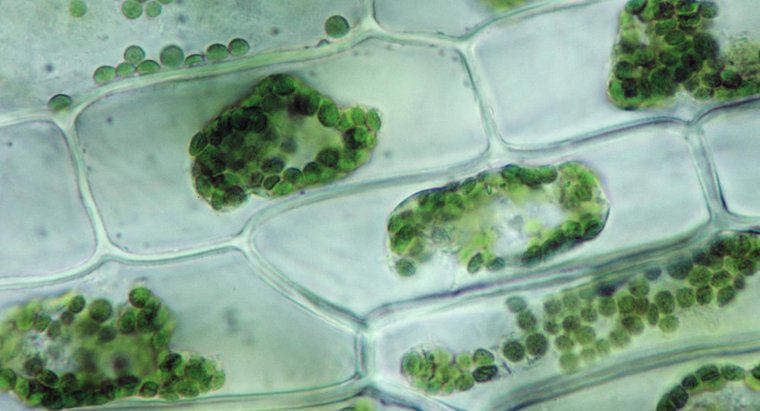
Osmoza este un tip particular de difuzie în care apa traversează o membrană semi-permeabilă într-o zonă cu o concentrație mai mare a solutului, în timp ce difuzia standard adesea permite mișcarea liberă atât a soluțiilor dizolvate cât și a solventului spre echilibru. Difuzia, în general, este mișcarea netă a moleculelor în soluție din zone cu o concentrație mai mare în zone cu concentrație mai scăzută. Presiunea osmotică este potențial foarte puternică, presiunea osmotică fiind singura forță necesară pentru a muta apa de la rădăcini la vârfurile celor mai înalți copaci din lume.