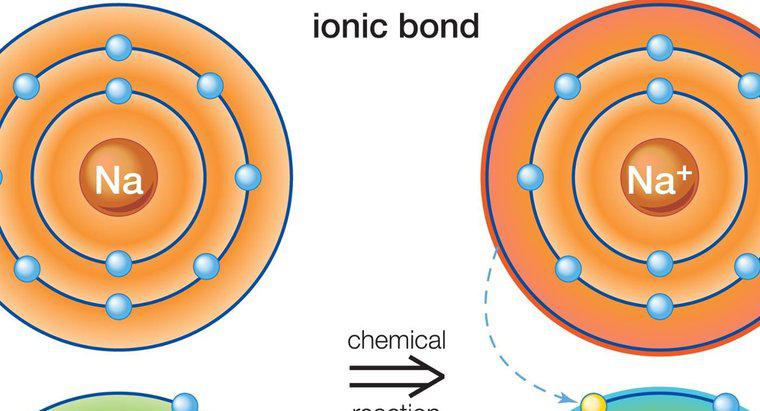
Atomii mai mari cu orbitale electronice complexe, cum ar fi cele găsite în metalele de tranziție, pot depăși regula octetului în condițiile corecte. În special, acestea apar atunci când elementele mai grele sunt legate de elemente mici, foarte electonegative cum ar fi fluor, clor sau oxigen. Un exemplu este pentaclorura de fosfor, un singur atom de fosfor legat de cinci atomi de clor, care are 10 electroni împărțiți în cochilia exterioară a valenței.
Atunci când un element are un număr suficient de mare pentru atomi, este disponibil un nou tip de electron orbital cu o capacitate de până la 10 electroni, permițând până la cinci legături simple. Asta se întâmplă cu pentaclorura de fosfor. Pentru a folosi această orbitală, totuși reacția care creează compusul care folosește această orbitală trebuie să fie foarte favorabilă din punct de vedere energetic. De aceea, pentru a-l face să funcționeze, trebuie implicate elemente cu o capacitate foarte puternică de a atrage și lega electroni, de asemenea cunoscut sub numele de electronegativitate. Oxigenul are o electronegativitate ridicată, dar este puțin probabil să creeze un compus cu cinci atomi legați cum ar fi clorul, deoarece necesită doi electroni pentru a-și completa cochilia de valență exterioară. Fluorul și clorul necesită fiecare câte unul, astfel încât acest tip de configurație să fie mai probabil.