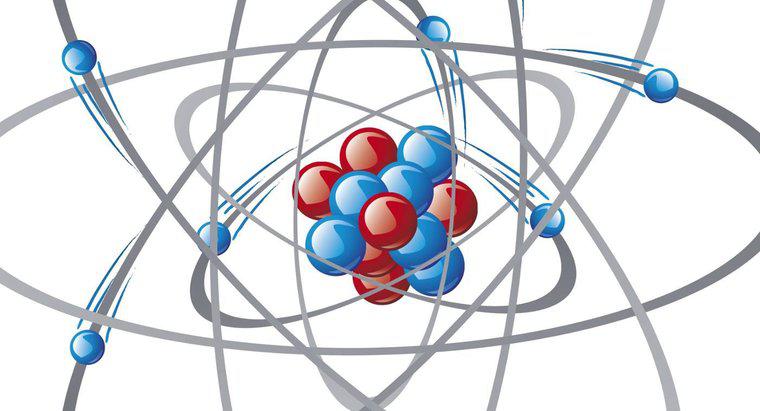
Modelul lui Bohr al atomului de hidrogen constă într-un proton greu orbit de un electron. Este cel mai bine descris ca o planetă care orbitează o stea. În loc de gravitate oferind forța atractivă pentru sistem, electronul este atras de proton prin forțe electrostatice.
Niels Bohr și-a prezentat modelul în 1913 și a prezis cu succes structura atomului de hidrogen. Conceptul se bazează pe teoria că electronii ar putea exista numai în orbite energetice specifice. Orbita cea mai apropiată de proton a avut cea mai mică energie și energia a crescut mai departe de proton. Un foton ar putea scoate electronul din orbita sa, intr-o orbita energetica mai mare, cauzand o absorbtie a energiei sau intr-o orbita energetica mai mica, creand o eliberare de energie. Cea mai mică și cea mai stabilă orbită de energie a fost numită n = 1 și fiecare orbită a fost numerotată secvențial de acolo.
Modelul lui Bohr este primitiv prin standardele moderne și nu reușește complet atunci când extrapolează structura atomilor mai mari. Modelul său presupune că cineva cunoaște poziția și impulsul electronului, ceea ce este imposibil, în conformitate cu principiul incertitudinii Heisenberg. De asemenea, el nu a reușit să considere interacțiunea electron-electron în atomi mai mari. În timp ce este învechit, modelul Bohr contribuie la introducerea conceptului de mecanică cuantică.