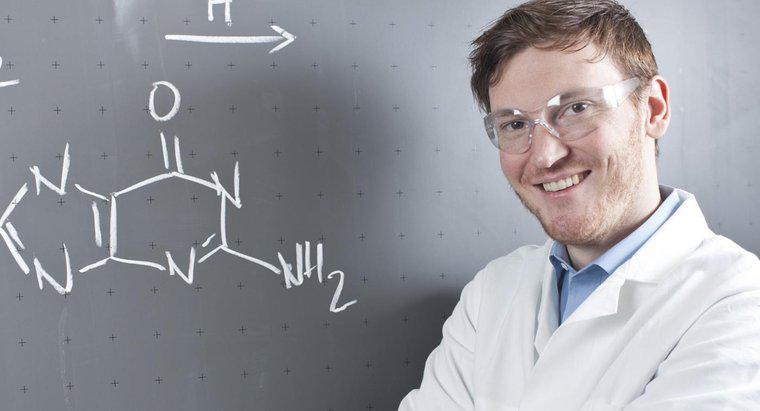
O săgeată care indică ambele direcții într-o ecuație chimică arată că reacția este reversibilă și poate continua în ambele direcții. Aceasta înseamnă că reactanții din partea stângă sunt, de asemenea, cei din dreapta și invers.
Este incorect să scrieți o reacție reversibilă ca două ecuații chimice separate (câte una pentru fiecare direcție) deoarece produsele reacționează întotdeauna și revin înapoi în reactanții originali. Deoarece ambele reacții se întâmplă simultan, sistemul chimic se află într-o stare de flux până la atingerea echilibrului. Aceasta înseamnă că există un punct în care concentrația fiecărui reactant rămâne constantă și nu prezintă o schimbare netă în timp. Aceasta nu înseamnă însă că fiecare reactant este prezent în proporții egale.
Rata reacției și coeficienții de reacție ai fiecărui reactant determină cât de mult este produs și cât de repede. Deoarece unele reacții sunt mai rapide și necesită cantități mai mari de un reactant decât altul, ele nu sunt prezente în cantități egale când sistemul ajunge la echilibru. În sistemele de echilibru dinamic, ratele de reacție pentru ambele părți ale ecuației sunt exact aceleași, astfel încât concentrațiile reactanților și produselor rămân constante chiar dacă ambele reacții continuă să se desfășoare pe o perioadă nedeterminată.