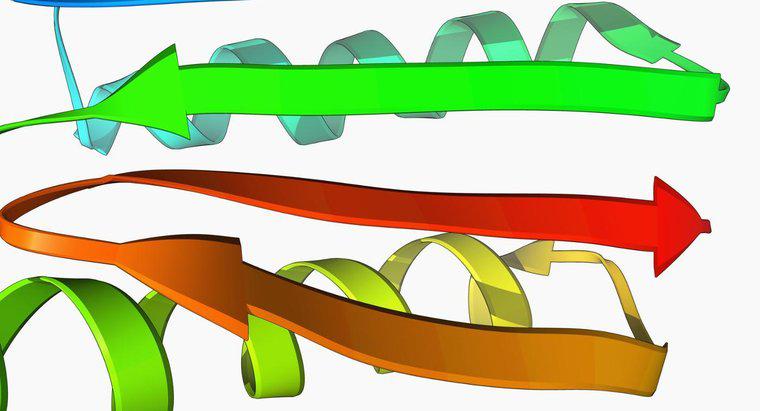
Forma unei proteine este determinată de cele patru niveluri ale structurii proteice: primar, secundar, terțiar și cuaternar. Alte proteine chaperon sunt prezente în celulă și se asigură că o proteină se îndoaie forma corectă.
Proteinele sunt compuse din polipeptide în care o secvență de aminoacizi este legată prin legături peptidice. Această secvență este denumită structură primară a proteinelor. Structura primară este raportată cel mai adesea prin abrevieri de o literă sau trei litere pentru aminoacizii, enumerați începând cu partea N-terminală. Structura secundară este un segment pliat regulat dintr-o proteină formată prin legături de hidrogen între atomii de bază ai aminoacizilor. Cele două tipuri principale de structuri secundare sunt heliile alfa și foile de beta. O alfa helix conține 3,6 aminoacizi pe viraj elicoidal. Prolinul aminoacid nu se încadrează într-o helix datorită structurii sale rigide. Foliile beta conțin lanțuri de legături peptidice care se aliniază de-a lungul celeilalte. Acestea pot fi fie paralele, în care ambele fire se aliniază direcțional, fie analitic, în care fiecare foaie este direcționată opus.Structura terțiară este structura tridimensională a întregului lanț peptidic. În diagramele de proteine, helicile alfa sunt în general prezentate ca bobine, iar foile beta sunt arătate ca o panglică plană. Structura terțiară este menținută de interacțiunile unei catene laterale de aminoacizi determinate prin caracteristicile lor. Structura cuaternară este prezentă în proteine care conțin mai mult de un lanț polipeptidic, denumit un domeniu. Este aranjamentul spațial al domeniilor.