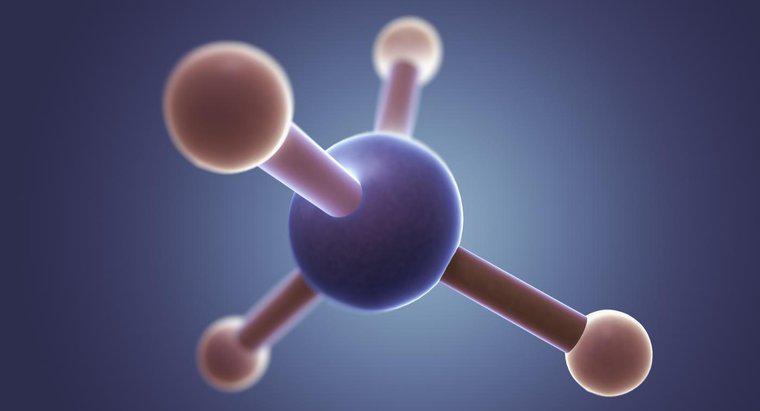
Structura punctului Lewis pentru CH2F2, formula chimică pentru difluorometan, este un C în centru cu linii de fiecare parte față de cele două H și cele două F. Fiecare H contine 3 perechi de puncte in jurul partilor nelegate.
În structura lui Lewis, C reprezintă carbonul, H reprezintă cei doi atomi de hidrogen, F reprezintă cei doi atomi de fluor, punctele reprezintă electroni, iar liniile reprezintă o pereche de electroni legați. Fiecare atom de fluor conține șapte electroni de valență. Acest număr poate fi determinat prin coloana de fluor din tabelul periodic. Fiecare atom de carbon are patru electroni, de asemenea, arătat de coloana sa pe tabelul periodic. Pentru a lega cu doi atomi de fluor, atomul de carbon trebuie să creeze o singură legătură cu fiecare atom de fluor, folosind electronii de valență. Unul din cei șapte electroni de valență de la atomii de fluor se leagă cu un singur electron de atomul de carbon, lăsând fiecare atom de fluor cu șase electroni de valență necondiționate. În structura punctului Lewis, acești electroni rămași sunt reprezentați de puncte plasate în mod egal în jurul simbolului elementelor. Pentru a verifica dublu acuratețea structurii punctului Lewis, elevii pot număra toți electronii, numărând fiecare punct ca un electron și fiecare legătură ca doi electroni. Numărul de electroni din structură ar trebui să fie egal cu numărul de electroni din CH2F2.Postări similare
Alte postări interesante