Atunci când două sau mai multe elemente chimice diferite combină, ele formează un compus. Modul în care acești atomi se îmbină sau se leagă depinde de element și de caracteristicile sale. Legătura care deține atomii determină împreună tipul de compus și acestea pot fi fie ionice, fie covalente.
Elementele de bază ale lipsei Atomii sunt clasificați și caracterizați de numărul de electroni pe care îl conțin. Fiecare element are un număr diferit de electroni adăpostiți în orbitele care se deplasează în jurul nucleului. Orbita exterioară este cunoscută ca orbitală de valență, iar acești electroni sunt cei utilizați în procesul de legare. Fiecare atom încearcă să aibă o orbită exterioară plină de electroni pentru a fi stabilă. Pentru majoritatea atomilor, această orbită exterioară deține opt electroni. Regula de octet se referă la cerința ca electronii să câștige, să piardă sau să împartă electroni pentru a umple orbita exterioară. Când atomii câștigă sau dau electroni unui alt element, ele formează compușii ionici. Când atomii împart electroni cu un alt element, ei formează compuși covalenți.
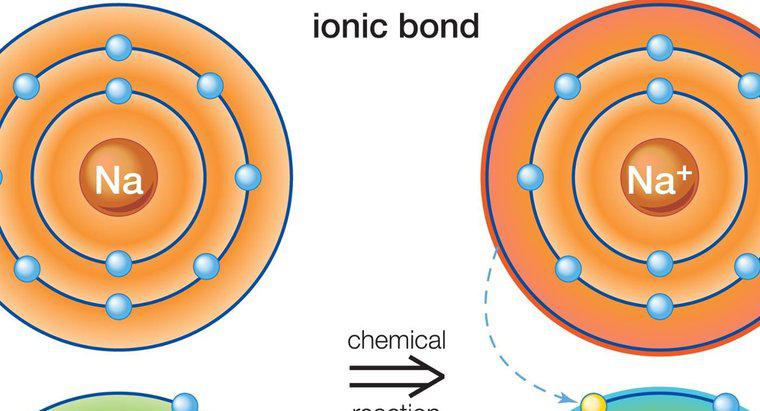
Compușii ionici
Compușii ionici se formează între metale și nemetalici. Metalele au în general câțiva electroni de valență în orbita exterioară, în timp ce nemetalicii au multe. Metalul acționează ca un donator și transferă electronii de valență la metalul nemetal, satisfăcând astfel regula de octet necesară pentru a forma un atom stabil. Aceasta are ca rezultat un atom de metal încărcat pozitiv și un atom nemetal încărcat negativ, cunoscut ca ioni. Datorită încărcăturilor opuse, cei doi ioni sunt atrase unul de celălalt și rămân aproape împreună, formând astfel un compus ionic. Mai mult de un electron poate fi transferat în acest proces. Deoarece atomii încărcați plutesc liber, aceștia sunt atrași de alți atomi cu încărcătură opusă, nu doar atomul singular pe care l-au donat sau au primit electroni.
Caracteristicile compușilor ionici sunt că acestea sunt solide cristaline cu puncte de topire și puncte de fierbere ridicate. Ei conduc energie electrică atunci când sunt topiți și sunt solubili în apă, dar nu și în lichide nepolare. Unul dintre cei mai obișnuiți compuși ionici este clorura de sodiu (NaCl), cunoscută și ca sarea de masă.
Compuși covalenți
În schimb, compușii covalenți apar în mod obișnuit între nemetalici sau doi atomi ai aceluiași sau a unor elemente similare. Atomii cu electronegativități similare, care pot fi determinate din tabelul periodic, tind să se atragă unul pe altul și să formeze legături covalente. În loc să transfere complet electronii de valență, atomii împart electronii externi pentru a satisface regula octeților. Electronii partajați se pot deplasa înainte și înapoi între atomii legați. Nici un atom nu câștigă sau nu pierde un electron în acest tip de legătura, astfel încât nu se formează ioni. Din acest motiv, atomii din compus nu sunt atrași de alți atomi din apropiere, precum cei observați în compușii ionici. Compușii covânați pot fi solide, lichide sau gaze. Acestea tind să fie conductori electrici săraci și au puncte de topire și de fierbere scăzute. Acestea tind să fie solubile în lichide nepolare, dar nu în apă. Unele exemple comune ale compușilor covalenți sunt metanul (CH4) și dioxidul de carbon (CO2).