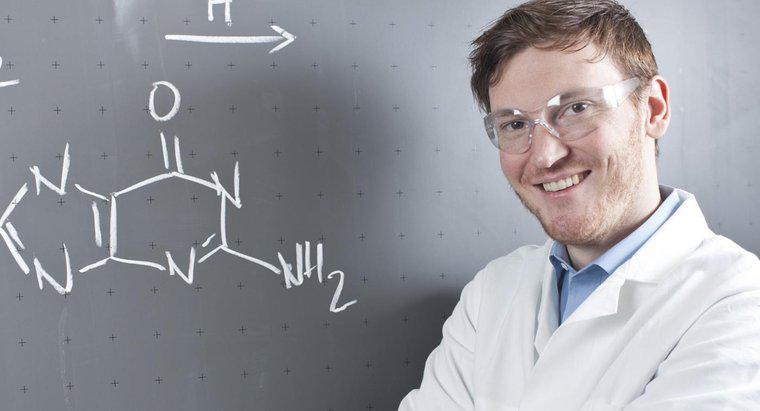
Ecuațiile chimice trebuie să fie întotdeauna echilibrate datorită principiilor enunțate în Legea conservării materiei. Această lege științifică afirmă că materia nu poate fi creată din nimic și nici nu poate fi distrusă. Prin urmare, aceeași cantitate de materie, sub formă de atomi, trebuie să existe atât înainte, cât și după reacția chimică. Problema poate schimba forma sau locația, dar nu poate dispărea complet sau nu pare nimic.
Este uneori mai ușor să-ți imaginezi atomii care formează o ecuație chimică ca ceva mai mare. De exemplu, dacă cineva face salată, ar putea să înceapă cu un cap de salată, o tomată întreagă și un morcov. Trebuie sa taie aceste legume pentru a face salata, dar nu a facut ca unele legume sa dispara doar pentru ca le taie in bucati mai mici. Legume noi nu au fost create, componentele salatei au fost amestecate. Același lucru este valabil și pentru ecuațiile chimice care încep cu o anumită cantitate de un element și se termină cu aceeași cantitate, la nivel atomic, a altui element.
Una dintre cele mai simple ecuații chimice este H2 + O2 -> H2O. Adică, doi atomi de hidrogen și un atom de oxigen se combină pentru a forma o singură moleculă de apă.