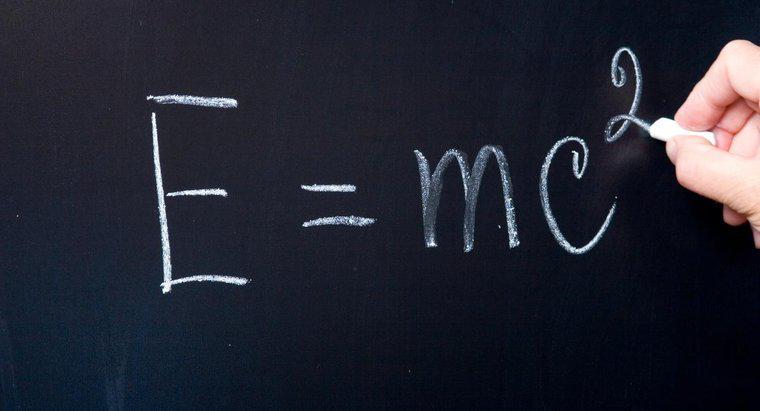"Cel mai înalt nivel de energie ocupată" înseamnă nivelul de energie în care locuiesc electronii de valență. Elementele urmează regula de octet, adică doresc să atingă un aranjament stabil de a avea opt electroni în cea mai mare ocupată nivel de energie. Unii atomi vor să renunțe la electroni, iar alții vor să câștige electroni pentru a deveni mai stabili.
Electronii de Valence există doar în orbitalele s și p celui mai înalt nivel de energie. Principiul Aufbau afirmă că electronii trebuie să umple mai întâi cele mai scăzute niveluri de energie înainte de a trece la următorul nivel de energie. Fiecare nivel de energie are un număr specific de orbite; numai doi electroni care se rotesc în direcții opuse pot umple fiecare orbitală. Electronii există la distanțe diferite de nucleul atomului. Acești electroni care ocupă orbite mai aproape de nucleu au energie mai mică decât cele care orbitează mai departe.
Cele mai stabile elemente din tabelul periodic, gazele nobile, au opt electroni în cel mai înalt nivel de energie ocupat; gazele nobile nu formează ușor compuși cu alte elemente. Electronii din cel mai înalt nivel de energie ocupată au mult de-a face cu reactivitatea elementului. Elemente precum metalele cu câțiva electroni la cele mai înalte niveluri de energie doresc să le dărui altor elemente. Elemente precum nemetalele au aproape un complet complet de opt electroni la nivelurile lor extreme de energie, deci doresc să obțină electroni din elemente.