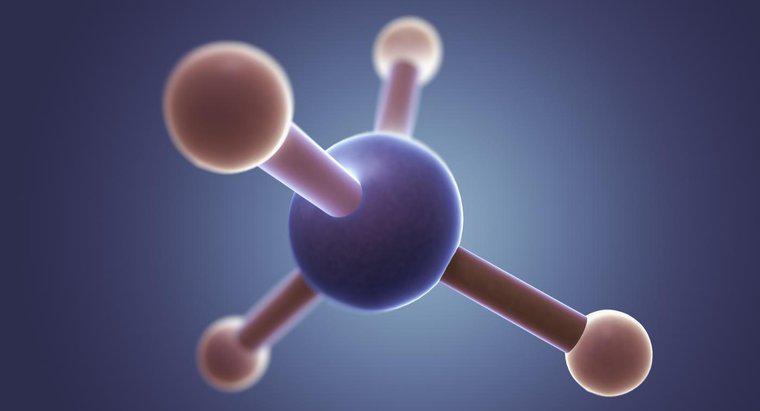
Formele moleculare sunt prezise folosind teoria repulsiei perechii de electroni a valenței (VSEPR). Potrivit VSEPR, moleculele vor avea o formă geometrică care le permite centrelor de încărcare negative (electroni perechi lipite și singure) să fie cât mai îndepărtate unul de celălalt, datorită repulsiei reciproce a încărcăturilor negative. Moleculele cu două centre negative au tendința de a fi liniară (un unghi de legătură de 180 de grade într-un plan bidimensional). Moleculele cu trei centre negative sunt planare triunghiulare (unghiuri de legătură de 120 grade într-un plan bidimensional), iar moleculele cu patru centre negative sunt tetraedrice (unghiuri de legătură de 108,5 grade într-un spațiu tridimensional).
Clorura de metil are un atom de carbon central înconjurat de patru legături simple (trei la hidrogen și unul la clor). Prin urmare, conform VSEPR, molecula va avea o formă tetraedrică cu un unghi de legătură de 108,5 grade pentru a permite o separare maximă a electronilor legați.Care este forma moleculară a CH3Cl?
Clorura de metil (CH3CI) are o forma tetraedrica cu un unghi de legatura de 109,5 grade. Acest lucru se datorează faptului că carbonul are patru electroni de valență care formează patru legături și într-un spațiu tridimensional, o formă tetraedală permite ca electronii legați să fie cel mai îndepărtați unul de altul.