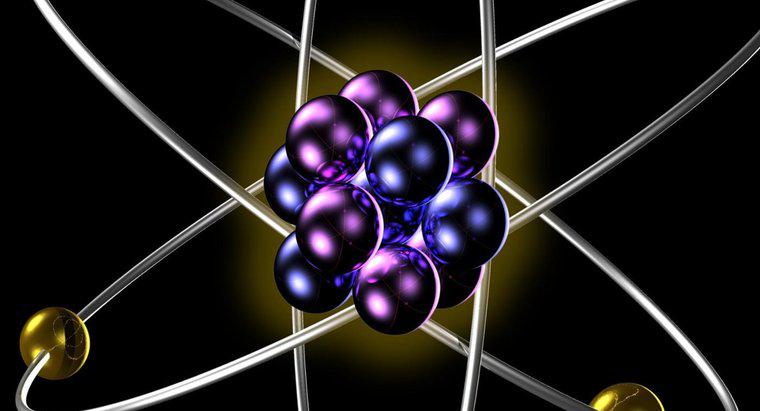
Izotopii aceluiași element au același număr de protoni și electroni atunci când sunt în formă atomică neutră. Izotopii diferiți au un număr diferit de neutroni în nucleele lor, rezultând greutăți atomice diferite pentru diferiții izotopi ai un singur element.
Numărul de protoni din nucleul atomilor unui element dă masa atomică a acestui element. Masa atomică este constantă pentru toți izotopii elementului. Deoarece masa atomică determină numărul de electroni care trebuie să orbiteze nucleul pentru ca atomul să fie neutru, această masă atomică determină comportamentul chimic al elementului, deoarece toate chimia non-nucleară rezultă din interacțiunile dintre norii electronilor de atomi cu unul o alta. Aceasta înseamnă că toți izotopii aceluiași element participă în același mod la reacțiile chimice.
O diferență în comportamentul izotopic apare atunci când nucleele anumitor izotopi sunt instabile din cauza unui dezechilibru al numărului de protoni față de neutroni din nucleu. Ar trebui să existe aproximativ un neutron pentru fiecare proton pentru ca un nucleu atomic să fie stabil. Pe măsură ce numărul de neutroni crește disproporționat față de numărul de protoni, nucleul devine instabil, înlăturând această greutate în exces de neutroni sub formă de particule alfa și beta și radiații gamma.