Compușii ionici conduc electricitatea atunci când sunt dizolvați în apă, deoarece mișcarea particulelor încărcate negativ și pozitiv încărcate formează un curent electric, explică About.com. În această stare lichidă, ionii încărcați separați și se mișcă liber, creând un curent de particule electrice care conduc electricitatea.
Conductivitatea electrică măsoară capacitatea unei substanțe de a produce un curent electric, în timp ce electricitatea este mișcarea particulelor încărcate care formează curentul electric. Un curent, în domeniul electric, este pur și simplu un flux de încărcături care necesită o mișcare liberă. Pentru ca curentul electric să se formeze, trebuie să existe atât mișcarea cât și conductivitatea.
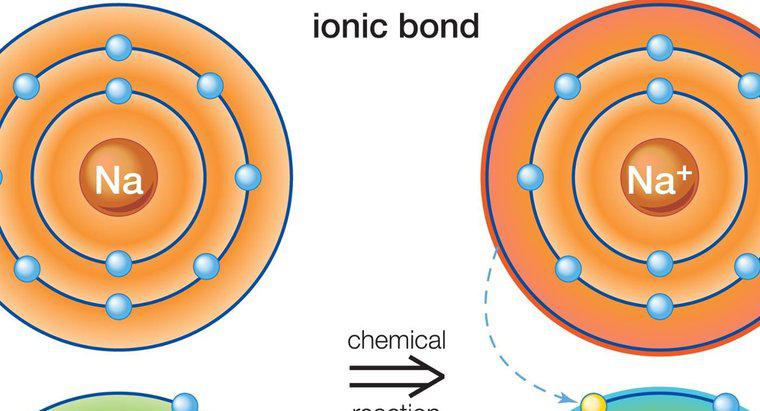
Compușii ionici se formează atunci când ionii încărcați pozitiv și negativ sunt legați strâns împreună. Acești ioni sunt atomi care au câștigat sau au pierdut un electron, și ei vin împreună prin transferul unui electron într-un proces numit legare ionică. Un ion încărcat pozitiv este un cation, în timp ce un ion încărcat negativ este un anion. Un exemplu de compus ionic este clorura de sodiu, NaCl, în care sodiul (NA) este cationul și clorul (Cl) este anionul. Compușii ionici în stare solidă au particule care sunt ținute strâns împreună, restricționând toate mișcările și împiedicând formarea curentului electric. În consecință, solidele ionice nu conduc energia electrică. Când se dizolvă în apă, legătura ionică este ruptă, ceea ce permite separarea ionilor încărcați și curgerea liberă. Apa asigură mișcarea particulelor, iar ionii separați asigură conductivitatea. Deoarece ambele sunt prezente, este creat un curent electric pentru a conduce electricitatea.